

Este capítulo consta dos itens abaixo. Caso queira ir direto a algum item,
1. - Introdução
clique aqui! 2. - Supercapacitores versus Baterias
clique aqui! 3. - Constituição de um Supercapacitor
clique aqui! 4. - Tipos de Supercapacitores
clique aqui! 4.1 - Supercapacitores de Dupla Camada
clique aqui! 4.2 - Pseudocapacitor
clique aqui! 4.3 - Supercapacitores Híbridos
clique aqui! 5. - Materiais Utilizados como Eletrodo
clique aqui! 5.1 - Carvão Ativado
clique aqui! 5.2 - Silício Poroso
clique aqui! 5.3 - Nanotubos de carbono
clique aqui! 5.4 - Grafeno
clique aqui! 6. - Eletrólitos
clique aqui! 7. - Separador Elétrico
clique aqui! 8. - Características Elétricas do Supercapacitor
clique aqui! 8.1 - Capacitância em um Supercapacitor
clique aqui! 8.2 - Densidade de Potência
clique aqui! 8.3 - Características de Carga e Descarga de um Superccapacitor
clique aqui! 9. - Aplicações do Supercapacitor
clique aqui! 9.1 - Desenvolvimento do Carro Elétrico
clique aqui!
Nos dias de hoje, há uma crescente e contínua pesquisa por dispositivos capazes de armazenar grandes quantidades de energia em um determinado volume. A escolha do dispositivo energético a ser usado deve considerar a demanda energética e a aplicação a qual é destinada.
Dessa forma, os principais parâmetros que caracterizam um dispositivo de armazenamento de energia são a
É nesse contexto que surgem os
Os dois principais sistemas de armazenamento de energia elétrica são o
Atualmente os
| Função | Supercapacitor | Bateria Lítio |
| Tempo Carga | 1 a 10 s | 15 min. a 2 h |
| Ciclo de Vida | Maior que 20 anos | 4 a 10 anos |
| Tensão de Operação (V) | 2,3 a 5,6 | 3,7 (nominal) |
| Energia Específica | 15 a 73 Wh/Kg | 120 a 250 Wh/Kg |
| Potência Específica | até 15 kW/Kg | 1 a 3 kW/Kg |
| Custo kWh | ≅ $5.000 | $250 a $1.000 |
| Temperatura de Carga (°C) | - 45 a +70 | 0 a +45 |
| Temperatura de Descarga (°C) | - 45 a +70 | - 20 a +60 |
| Eficiência (%) | 85 a 98 | 70 a 85 |
| Número de Carga e Descarga | Maior que 100.000 | 6.000 a 10.000 |
Observando a
Essa última característica (citada acima) está sendo implementada em trens urbanos e suburbanos. Assim, quando o trem está se aproximando
de uma estação de embarque/desembarque, ao diminuir sua velocidade, o trem entra em um regime de
Um
O
O
O
Supercapacitores de dupla camada elétrica usam eletrodos de carvão ativado, ou grafeno (que é uma das formas alotrópicas do carbono) que aumenta em muitas vezes a capacitância de dupla camada, pois a área específica chega a atingir centenas de metros quadrados por grama, apresentando muito maior capacitância que os capacitores que utilizam princípios eletroquímicos. Cabe salientar que este tipo de supercapacitor usa somente fenômenos físicos via eletrostática, não sendo envolvida qualquer mudança química no processo de carga e descarga.
A alta capacitância dos supercapacitores de dupla camada
elétrica é obtida devido à ínfima distância existente entre a superfície da armadura fixa
(superfície do carvão ativado ou do grafeno) e a camada eletrostática que é formada por
íons envoltos por uma tênue camada do solvente, cuja espessura da camada de solvente é
da ordem de décimos de nanômetros (tipicamente
Os supercapacitores utilizam a capacitância decorrente da separação de carga na interface eletrodo-eletrólito. Esse arranjo de cargas na interface origina a dupla camada elétrica. Um eletrodo polarizável é aquele onde não ocorre transferência de carga quando seu potencial é variado. Portanto, todo aumento de potencial leva a um aumento de capacitância de dupla camada elétrica. Se a área eletródica é aumentada através de poros, grandes quantidades de carga podem ser armazenadas em um supercapacitor.
Este tipo de supercapacitor possui um eletrodo positivo com deficiência em elétons, e outro negativo, com excesso de elétrons, ambos em contato com um eletrólito. Um separador permeável a íons é posicionado entre os eletrodos. Durante o carregamento, o eletrodo negativo atrai cátions, enquanto os ânions são acumulados pelo eletrodo carregado positivamente.
Para construção de um capacitor de dupla camada elétrica, o material dos eletrodos deve ser estável em relação à solução eletrolítica, portanto, processos faradaicos como oxidação, corrosão e formação de filme de óxido não devem ocorrer. Para isso, pesquisas buscam materiais eletródicos não corroentes, tais como o carvão ativado que apresenta ampla aplicação em capacitores eletroquímicos devido ao seu baixo custo, alta área específica e alta estabilidade para aplicações tecnológicas.

Na
O processo eletroquímico acontece após a aplicação de uma diferença de potencial (ddp), onde ocorre um acúmulo de carga (polarização) nos eletrodos. Durante o processo de carga, os elétrons migram do eletrodo positivo para o eletrodo negativo, com isso, os íons presentes no eletrólito migram por difusão para os poros na superfície dos eletrodos com o propósito de manter o equilíbrio eletrostático do sistema. Para evitar a recombinação de íons nos eletrodos, a dupla camada de carga é formada. A dupla camada, combinada com a área superficial específica dos eletrodos, e com a diminuição da distância entre os eletrodos, permite que o mesmo atinja valores altos de densidade de energia.
Neste processo, um eletrodo
negativamente carregado, observa-se na superfície do eletrodo moléculas de solvente
adsorvidas pela interação dipolo-eletrodo. Nesta etapa podem estar também
adsorvidos ânions de grande raio iônico e com baixa solvatação. O plano onde
encontram centrados todos os íons adsorvidos especificamente é denominado
A
O primeiro modelo de dupla camada foi proposto por
Pensando nisso,

Geralmente, a espessura da dupla camada elétrica é da ordem de
Ilustra-se também na

A
A pseudocapacitância de um material pode ser intrínseca ou extrínseca. No
primeiro caso, os materiais possuem comportamento pseudocapacitivo para
diferentes tipos de morfologias e tamanho de partículas. Já a pseudocapacitância
extrínseca somente aparece sob severas condições, como por exemplo, materiais
com dimensões nanométricas, enquanto que o mesmo comportamento não é
observado no material do tipo
Quando um potencial é aplicado a um pseudocapacitor, ocorre o processo de
redução e oxidação no material do eletrodo, envolvendo a passagem de carga
através da dupla camada, resultando na passagem de corrente farádica pela célula
do supercapacitor. O processo farádico envolvido nos supercapacitores permite que
eles atinjam uma capacitância específica cerca de
Existe uma diferença
fundamental entre o comportamento eletroquímico destes capacitores em relação ao de
baterias. A forma como uma bateria e um capacitor eletroquímico armazenam energia
química e a reverte em energia elétrica são diferentes. Pelo menos idealmente, o
armazenamento de energia eletroquímica em um capacitor eletroquímico ocorre
localmente numa região bidimensional, na interface eletrodo/eletrólito, através de reações
rápidas e reversíveis, e, portanto, não envolvem mudanças de densidade no interior do
eletrólito ou eletrodo. Já nas baterias, o armazenamento da energia eletroquímica envolve
uma região no volume tridimensional, no interior do eletrólito e eletrodos, onde ocorrem
mudanças de densidade através de reações químicas reversíveis, porém mais lentas. Por
ocorrer numa interface e ter rápida reversibilidade, assemelhando-se muito a um
armazenamento de energia eletrostática, o armazenamento de energia eletroquímico em
capacitores eletroquímicos é denominado
Como vimos, os supercapacitores de dupla camada elétrica oferecem boas estabilidades cíclicas e bom desempenho de energia. Os supercapacitores pseudocapacitivos oferecem alta capacitância específica. No caso de um sistema híbrido, ele oferece uma combinação de ambos, isto é, combinando a fonte de energia do eletrodo do tipo bateria, com uma fonte de energia do eletrodo tipo capacitor na mesma célula. Com uma combinação correta de eletrodos, é possível aumentar o potencial da célula, o que leva a uma melhoria nas densidades de energia e potência do sistema.
A chave para que o sistema se comporte como um supercapacitor, independente do mecanismo no qual opera, consiste na natureza do material utilizado como eletrodo. São relatados na literatura diversos materiais que podem ser utilizados como eletrodos como por exemplo: óxidos metálicos (RuO2, NiO, MnO, Co3O4), sulfetos metálicos, materiais a base de carbono (Grafeno, Nanotubos de Carbono, Carvão Ativado, Carbono mesoporos), e nanocompósitos. Dos materiais utilizados como eletrodos, os materiais a base de carbono, como o grafeno, são os mais utilizados

Na
As principais características que um eletrodo deve ter, para um supercapacitor de dupla camada, são uma área superficial elevada e uma boa condutividade (ou baixa resistividade). Um dos primeiros materiais a ser empregado em eletrodos de supercapacitores foi o carbono ativado e ainda é o mais utilizado comercialmente devido as boas características citadas anteriormente. Além disso possui baixo custo quando comparado com outros materiais. Vamos analisar alguns tipos de materiais que podem ser usados como eletrodos.
O
A seguir, é realizado o processo de ativação ao levar esse carvão a um forno de alta temperatura (
O silício poroso é um material obtido a partir do silício monocristalino, composto de poros que se assemelham a poços cilíndricos que se estendem perpendicularmente à superfície do substrato de silício, cuja profundidade determina a espessura da camada.
O avanço científico e tecnológico empregado no estudo dos compostos de
carbono ocasionou a descoberta de uma importante forma alotrópica designada
Os nanotubos de carbono são cilindros longos formados por átomos de carbono
covalentemente ligados a outros três, formando uma estrutura hexagonal com
hibridação

Os nanotubos de carbono podem ser considerados como uma folha única de
grafeno enrolada ao longo de um eixo característico na forma de cilindro. O eixo no
qual as folhas se enrolam é responsável pela quiralidade dos nanotubos de carbono. Este eixo é definido
por vetores posicionados na célula unitária do nanotubo e o enrolamento pode se dar de
diferentes formas, originando três possíveis classificações de quiralidade para os nanotubos de carbono:
Entenda-se por
Nanotubos de carbono de parede simples possuem diâmetro da ordem de
No campo do armazenamento, conversão e transmissão de energia elétrica os nanotubos de carbono também estão sendo amplamente utilizados. Os nanotubos de paredes múltiplas estão sendo usados em baterias de íons lítio misturados aos materiais do cátodo e do ânodo, aumentando a condutividade elétrica e a resistência mecânica, o que implica em um aumento no ciclo de vida das baterias. Também têm sido aplicados, tanto puros quanto em compósitos, em materiais de eletrodos para supercapacitores, incluindo dispositivos flexíveis de altíssimo desempenho.
O
O grafeno tem sido considerado como um dos materiais mais promissores para eletrodos em dispositivos eletroquímicos. Vários trabalhos na literatura tem proposto o uso do grafeno para a fabricação de eletrodos sugerindo que esta classe de material pode, em pouco tempo, complementar os avanços tecnológicos atingidos pelos nanotubos de carbono.
Um método de síntese reprodutível para a obtenção de grafeno é através de exfoliação mecânica. Esta técnica tem sido muito usada, porém muitos esforços têm sido feitos para o desenvolvimento de novas rotas de processamento que possibilitem a obtenção eficiente de grafeno em larga escala. Atualmente, três métodos principais de síntese são utilizados, sendo um método físico, um método químico e o terceiro, por deposição química a vapor.
A vantagem do uso de nanomateriais de carbono está na versatilidade que apresentam em propriedades estruturais e texturais, além da alta condutividade elétrica, baixos valores de densidade e elevada compatibilidade com outros materiais.
Os
Estes eletrólitos reúnem um conjunto de características muito interessantes, tais como boa estabilidade química e térmica, pressão de vapor negligenciável, elevadas densidades, são líquidos sob uma ampla faixa de temperatura, inflamabilidade desprezível, baixa toxicidade, alta condutividade iônica e ampla janela eletroquímica de potencial. No entanto, o conhecimento sobre suas propriedades físicas e químicas é ainda limitado e o grande número de diferentes combinações de cátions e ânions intensifica ainda mais o problema.
Devemos ter um eletrólito que seja quimicamente inerte a fim de não atacar quimicamente os materiais do supercapacitor, permitindo longa vida e estabilidade aos parãmetros elétricos do supercapacitor. O eletrólito também deve possuir uma baixa viscosidade para permitir que os íons permeiem os poros do eletrodo.
Como a energia contida nos capacitores aumenta com o quadrado do potencial, pesquisadores procuram uma forma de aumentar o valor do potencial de ruptura do eletrólito.
O separador elétrico, ou seja, a membrana de separação elétrica, proporciona uma separação física entre os eletrodos para evitar curtos circuitos devido ao contato direto entre os mesmos. Ele deve ser muito fino, da ordem de alguns milésimos de milímetros e, naturalmente, deve possuir uma grande porosidade para permitir a fácil passagem dos íons solvatados e, assim, reduzir a resistência em série equivalente. Os separadores elétricos também devem ser quimicamente inertes para preservar a estabilidade dos eletrodos e a condição de condutividade. Para reduzir os custos de processo de fabricação utiliza-se papel como separador elétrico em alguns modelos de supercapacitores.
8.1 Capacitância
Os supercapacitores têm sua capacitância dada pela
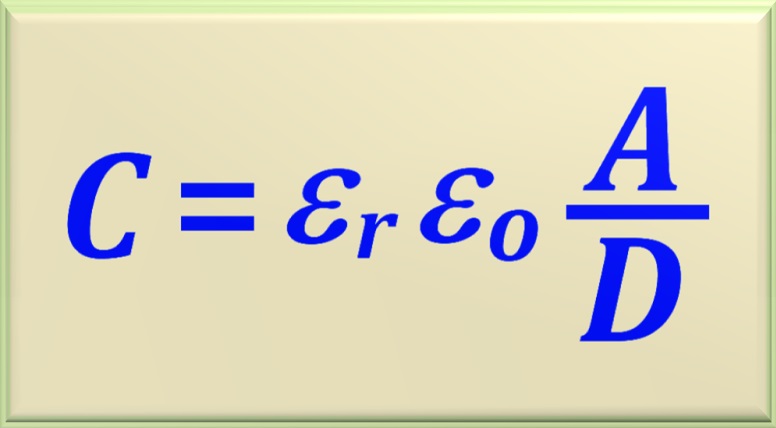
Onde as variáveis são:
Assim, a chamada
Para o cálculo da capacitância é possível outra abordagem sabendo que ela depende da carga e da tensão sobre o capacitor.
Assim, a

Essa equação expressa o valor da capacitância conhecendo a corrente de carga do capacitor e o tempo que decorre
até a tensão sobre o capacitor variar
Por outro lado, sabemos que o material que é usado nos eletrodos deve apresentar alta porosidade, formado por microporos, como se fosse um material esponjoso, já que essa característica proporciona alta área superficial específica, permitindo se conseguir alta capacitância específica. Como vimos anteriormente, carvão ativado e grafeno são os materiais mais utilizados na fabricação de supercapacitores. Dessa forma, podemos concluir que se desejarmos um supercapacitor com grande densidade de energia, usamos material que possua pequenos microporos. Caso contrário, ou seja, desejamos alta densidade de potência, então optamos por materiais que possuam microporos maiores, pois assim reduzimos a resistência em série equivalente do supercapacitor.
8.2 Densidade de Potência
O parâmetro limitande da potência que um supercapacitor pode fornecer a um circuito é a resistência em série equivalente.
Podemos calcular qual é essa potência utilizando o

No mercado eletrônico encontramos supercapacitores de
8.3 Característica de Carga e Descarga em um
SupercapacitorOs supercapacitores de
No caso de uma

Observe como a bateria de íon-lítio mantém uma tensão quase constante enquanto fornece energia ao dispositivo. Quando há o esgotamento da energia, a tensão decai abruptamente. Neste caso, há necessidade de recarregar a bateria.
No entanto, esta realidade é um pouco diferente quando se trata dos

Após tudo que foi visto até aqui vamos estudar de que forma podemos aplicar todas as vantagens que o supercapacitor oferece.
Devemos ter em mente que o supercapacitor tem como melhor característica a
9.1 Desenvolvimento do Carro Elétrico

Não é de hoje que há um desejo em se desenvolver uma tecnologia satisfatória para que os automóveis possam ter um motor elétrico como elemento propulsor. A fonte de energia para os motores elétricos é limpa e inesgotável, contrariamente aos combustíveis fósseis que possuem data para seu esgotamento. Além disso, há uma grande expectativa que os combustíveis fósseis alcancem um preço exorbitante quando próximo de seu esgotamento.
A resposta para este dilema está exatamente na tecnologia. A possibilidade de produzir energia elétrica a custo cada vez menor, limpa e renovável, é um potencial fantástico para diminuir o custo de abastecer um veículo. Há também uma vantagem em função da eficiência que o carro elétrico possui transformando energia elétrica em energia mecânica. Praticamente toda a energia disponível é convertida em potência mecânica.
Para conseguir fabricar carros elétricos com a mesma capacidade e autonomia dos carros a combustíveis fósseis, várias abordagens estão sendo testadas pelas empresas neste momento de transição. Hoje, utilizando motores elétricos, existem quatro tipos de carros que podemos descrever:
Com o desenvolvimento dos

Na
Muitos fabricantes de automóveis estão aderindo ao uso de supercapacitores, não só para dar partida, mas também distribuindo vários supercapacitores pelo corpo do carro para atender as necessidades de faróis, sinaleiras, rádios, etc ...

Um desses fabricantes é a
Assim, espera-se que com o avanço na tecnologia de fabricação dos supercapacitores possamos em um futuro próximo
substituir as baterias usadas em automóveis e outros tipos de veículos, por
9.2 Aplicações no Transporte Ferroviário
Em desenvolvimento.